1.1.PENDAHULUAN
Logam alkali adalah kelompok unsur kimia pada golongan IA dalam tabel periodik,kecuali hidrogen yang merupakan unsur non logam. Kelompok ini terdiri dari : litium ( Li ), natrium (Na), Kalium (K), Rubidium (Rb), Sesium (Cs), dan Fransium (Fr). Semua unsur pada kelompok ini sangat reaktif sehingga secara alami tak pernah di temukan dalam bentuk tunggal. Untuk menghambat reaktivitas , logam alkali harus di simpan dalam medium minyak.
1.2. SIFAT FISIKA
Semua logam alkali merupakan unsur logam yang lunak (mudah di iris atau di potong dengan pisau). Pada saat logam di bersihkan, terlihat warna logam putih mengkilap (seperti perak).
Gambar 1.1. Warna masing-masing logam Litium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Sesium (Cs), dan Fransium (Fr).
Semua logam alkali memiliki titik leleh dan titik didih di atas suhu ruangan, berwujud padat pada suhu ruangan, kecuali sesium. Jika suhu lingkungan pada saat penggukuran melebihi 28 0C maka unsur sesium ini akan berwujud cair .
Tabel 1.1 Data Sifat Fisika unsur logam alkali
| Nama Unsur | Tampilan | Titik Leleh (0C) | Titik Didih (0C) | Kerapatan (g/mL) |
| Litium | Litium mengapung dalam minyak | 180,54 | 1.347,00 | 0,543 |
| Natrium | Potongan natrium di ruang vakum | 97,81 | 903,80 | 0,971 |
| Kalium | Bola kalium dalam cairan parafin | 63,65 | 774 | 0,862 |
| Rubidium | Rubidium dalam ruang vakum | 38,89 | 688 | 1,532 |
| Sesium | Cesium dalam ruang vakum | 28,40 | 678,4 | 1,878 |
Pada tabel diatas tampak bahwa kerapatan atau massa jenis logam Litium ( 0,543 gr/mL ), Natrium (0,971 gr/mL ) dan kalium (0,862 gr/mL ) lebih kecil dari massa jenis air maupun masa jenis minyak atau paraffin. Oleh karena itu ketiga logam tersebut terapung dalam minyak maupun paraffin. Sedangkan untuk rubidium dan Cesium yang memiliki massa jenis berturut-turut (1,532 gr/mL ) dan (1,878gr/mL) adalah lebih besar dari air maupun minyak maka kedua logam tersebut akan tenggelam dalam minyak maupun air.
Massa atom relatif Litium (6,941 sma) ke natrium (22,9898 sma) kemudian ke Kalium (39,098 sma) dan rubidium (85,469 sma) serta cesium (132,905 sma) semakin besar. Secara fisika seharusnya titik leleh dan titik didih dari litium ke cesium semakin besar. Karena semakin besar massa atom semakin sukar menguap sehingga semakin tinggi titik didihnya.
Tetapi faktanya sebagaimana ditunjukkan pada tabel 1.1 diatas ternyata titik leleh dan titik didih logam alkali dari litium ke cesium semakin kecil.hal ini bertentangan dengan fakta massa atom relatifnya. Ini berarti dalam kasus logam alkali massa atom relatif logam kurang berpengaruh terhadap titik leleh maupun titik didih logam tersebut. Lalu faktor apa yang berpengaruh terhadap titik leleh dan titik didih logam-logam alkali tersebut ?
Ini menunjukkan pengaruh ikatan logam terhadap titik leleh dan titik didih logam alkali. Sesuai dengan jari-jari atom, yakni semakin kecil jari-jari atom maka semakin kuat ikatan logam karena semakin besar gaya tarik menarik elektrostatik. Semakin kuat ikatan logam semakin besar energi yang diperlukan untuk memutuskan ikatan logam tersebut sehingga semakin tinggi titik leleh dan titik didih. Jari-jari atom dari litium ke cesium semakin besar, sehingga ikatan logam semakin lemah karena gaya tarik menarik elektrostatiknya semakin lemah sehingga ikatan logam menjadi lebih mudah diputuskan. Oleh karena itu titik leleh dan titik didihnya menjadi semakin kecil.
1.3 SIFAT PERIODIK
Sifat periodik dan sifat kimia unsur logam alkali terutama di tentukan oleh konfigurasi elektronnya yang memiliki satu elektron pada kulit terluarnya. Perbedaan sifat unsur yang satu dengan yang lain menunjukkan keteraturan , seperti terlihat pada tabel di bawah ini :
| Unsur | Konfigurasi Elektron | Jari-jari Atom (Å) | Energi Ionisasi (Kj/mol) | Keelektronega tifan | Potensial Reduksi (Volt) |
| 3Li | [He] 2s1 | 1,52 | 520.2 | 0,98 | -3,045 |
| 11Na | [Ne] 3s1 | 1,86 | 495,8 | 0,93 | -2,711 |
| 19K | [Ar] 4s1 | 2,27 | 418,8 | 0,82 | -2,924 |
| 37Rb | [Kr] 5s1 | 2,47 | 403 | 0,82 | -2,925 |
| 55Cs | [Xe] 6s1 | 2,65 | 375,7 | 0,79 | -2,923 |
Konfigurasi elektron valensi logam alkali adalah ns1 yang berarti terletak pada golongan IA dalam sistem periodic dan menempati blok s.logam alkali mempunyai satu elektron valensi sehingga untuk mencapai stabil dengan konfigurasi oktet,logam alkali lebih mudah melepaskan 1 elektron dan membentuk ion positif bervalensi satu.
L(s) → L(g)+ + e-
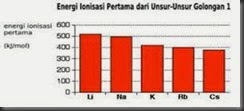
Untuk dapat melepaskan satu elektron valensinya,maka logam alkali membutuhkan energi.energi yang diperlukan oleh atom dalam keadaan gas untuk melepaskan satu elektron valensi,dinamakan: Energi Ionisasi.Besar atau kecilnya harga energi ionisasi suatu atom sangat dipengaruhi oleh jari-jari atom tersebut.Makin besar jari-jari atom suatu atom,makin lemah gaya tarik inti terhadap elektron valensi sehingga makin mudah elektron valensi dilepaskan dan semakin kecil energi ionisasi.Sebagaimana dapat dilihat pada Tabel 1.2,jari-jari atom dari litium ke cesium semakin besar.Oleh karena itu energi ionisasi dari litium ke cesium semakin kecil.
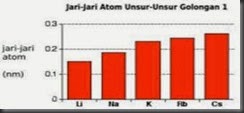
Besar atau kecilnya jari-jari atom sangat ditentukan oleh posisi(nomor kulit) tempat elektron valensi.Semakin besar nomor kulit tempat elektron valensi semakin jauh jaraknya dari inti sehingga semakin besar jari-jari atomnya.Karena yang dimaksud dengan jari-jari atom adalah jarak dari inti atom ke kulit ketempat elektron valensi.Nomor kulit tempat elektron valensi litium,natrium,kalium,rubidium,dan cesium berturut-turut adalah 1,2,3,4 dan 5.Oleh karena itu jari-jari atom cesium (2,65Å) > Rubidium(2,47Å) > Kalium(2,27Å) > Natrium(1,86Å) > Litium(1,52 Å).
(a)
(b)
Gambar 1.2 Grafik perbandingan jari-jari atom (a) dan
energi ionisasi (b) logam alkali
Untuk mencapai stabil dengan konfigurasi oktet,logam alkali lebih mudah melepaskan satu elektron dan membentuk ion positif bervalensi satu,oleh karena itu logam-logam alkali sangat sulit untuk melakukan reaksi reduksi atau reaksi penangkapan elektron,sehingga potensial reduksi semua logam alkali berharga negatif.
Keelektron negatifan adalah kecendrungan suatu atom untuk menarik elektron dalam satu molekul.Karena logam-logam alkali cenderung melepaskan elektron dari pada menarik elektron .Oleh karena itu harga keelektronegatifan logam-logam alkali relatif kecil yakni lebih kecil dari pada satu.Seperti halnya energi ionisasi,maka harga keelektronegatifan logam alkali dipengaruhi oleh jari-jari atomnya.Semakin kecil jari-jari atom semakin dekat jarak dari inti atom keelektron dalam molekul,sehingga makin mudah menarik elektron tersebut dan semakin keelektronegatifannya.
 20.48
20.48
 Unknown
Unknown










0 komentar :
Posting Komentar