Rabu, 29 April 2015
Rabu, 22 April 2015
 00.07
00.07
 Unknown
Unknown
3.1 PENDAHULUAN
Unsur-unsur pada golongan IIIA menunjukkan perbedaan sifat yang cukup bervariasi. Boron merupakan unsur nonlogam, alumunium merupakan unsur logam namun menunjukkan banyak kemiripan sifat kimia dengan boron dan unsur sisanya seluruhnya memiliki karakteristik sebagai unsur logam (Sharpe, 1992).
Meskipun keadaan oksidasi positif tiga (+3) merupakan karakteristik utama untuk semua unsur golongan IIIA, namun keadaan positif satu (+1 atau + saja) terdapat dalam senyawaan kimia semua unsur golongan IIIA kecuali boron, dan untuk thallium keadaan tersebut merupakan keadaan oksidasi yang stabil
3.2 SIFAT FISIKA
Alumunium murni merupakan logam berwarna putih keperakan dengan banyak karakteristik yang diperlukan. Sedangkan gallium sangat sulit ditemukan dalam keadaan melainkan hanya bias ditemukan sebagai biji gallium yang terdapat bersama-sama logam-logam yang lain. Sementara itu indium merupakan logam yang jarang ditemukan, sangat lembut, berwarna putih keperakan dan stabil didalam udara dan air tetapi larut dalam asam.
Pada tabel 3.1 berikut ini disajikan ringkasan beberapa sifat penting dari unsur-unsur golongan IIIA.
Tabel 3.1 Sifat Fisika Unsur-unsur logam golongan IIIA
| Unsur | Aluminium | Galium | Indium | Talium |
| Kerapatan (g/cm3) | 2,70 | 5,90 | 7,30 | 11,85 |
| Titik Leleh ( oC) | 659 | 30 | 156 | 304 |
| Titik Didih ( oC) | 2447 | 2237 | 2047 | 1467 |
Pada tabel diatas tampak sesuai dengan massa atomnya, dari aluminium ke talium yang makin besar, maka kerapatan atom massa jenis talium (11,85 g/mL) > indium (7,30 g/mL) > gallium (5,90 g/mL) > alumunium (2,70g.mL).
Seperti halnya pada unsur logam golongan alkali (golongan IA), maka titik didih unsur logam golongan IIIA sangat dipengaruhi oleh kekuatan ikatan logam sehingga titik didihnya dari alumunium ke gallium kemudian ke indium dan talium semakin kecil.
Namun pada titik leleh unsur logam golongan IIIA terjadi anomaly. Massa atom dan massa jenis alumunium < galium < indium < talium. Demikian juga dengan jari-jari atom alumunium < gallium < indium < talium. Jika titik leleh sangat dipengaruhi oleh massa atom seharusnya titik leleh aluminium paling rendah dan titik leleh talium paling rendah. Tetapi faktanya, titiki leleh aluminium dan titik leleh gallium paling rendah. Ini kemungkinan yang sangat berpengaruh terhadap titik leleh aluminium ikatan logam. Sedangakan pada gallium, indium dan talium yang palinng berpegaruh adalah massa jenis. Oleh karena itu titik leleh < gallium < indium <talium.
3.3 SIFAT PERIODIK
Seperti halnya logam alkali dan alkali tanah, sifat periodik dan sifat kimia logam golongan IIIA sangat di tentukan oleh konfigurasi elektronnya yang memeliki tiga elektron pada kulit terluarnya. Perbedaan sifat unsur yang satu dengan yang lain menunjukan keteraturan, seperti terlihat pada tabel di bawah tabel 3.2 di bawah ini. Pada tabel tersebut tampak kecenderungan sifat logam golongan IIIA sebagai berikut ::
· Jari jari atom cenderung bertambah besar dari Ga ke Tl, kecuali jari jari atom logam Al lebih besar dari pada Ga.
· Energi ionisasi pertama cenderung makin kecil dari Al ke Tl
· Keelektronegatifan cenderung bertambah dari Al ke Tl
Tabel 3.2 Sifat Periodik logam golongan IIIA
| Unsur | Konfigurasi Elektron | Jari-jari Atom (Å) | Energi Ionisasi (Kj/mol) | Keelektronega tifan | Potensial Reduksi (Volt) |
| 13Al | [Ne] 3s23p1 | 1,25 | 577 | 1,5 | -1,66 |
| 31Ga | [Ar] 4s24p1 | 1,24 | 579 | 1,6 | -0,56 |
| 49In | [Kr] 5s25p1 | 1,50 | 556 | 1,7 | -0,34 |
| 81Ti | [Xe] 6s26p1 | 1,55 | 590 | 1,8 | +0,72 |
Potensial reduksi berhaga negatif menyatakan bahwa unsur lebih mudah melepaskan dari pada menerima elektron karena melepaskan elektron merupakan sifat khas dari pada logam. Aluminium memiliki potensial reduksi negatif yang paling besar di antara kation golongan IIIA.
Ini menunjukan bahwa Al adalah logam yang paling aktif berubah menjadi Al+3. Energi ionisasi logam golongan IIIA hamper sama satu sama lain, kecuali energi hidrasi Al+3. merupakan yang terbesar diantara kation golongan IIIA.
Ada sifat menarik dari unsur Ga,In,dan Tl yang tidak terdapat pada Al,yaitu kemampuannya membentuk ion bermuatan satu. Kemampuan ini menunjukan adanya pasangan elektron lembam, nS2 ,dalam unsur paska peralihan (Post-transition). Jadi, sebuah atom Ga dapat kehilangan elektron pada 4P dan mempertahankan 4s untuk membentuk ion Ga+, dengan dangan konsfigurasi elektron [Ar]3d104s2. Kemungkinan ini lebih mudah terjadi pada atom yang lebih berat dalam golongan. Dalam kenyataannya, kalium dengan bilangan oksidasi +1lebih mantap dalam larutan berair dibanding kalium dengan bilangan oksidasi+3.
Ukuran ion yang kecil dan muatan ion yang besar (+3) serta tingginya energi ionisasi menyebabkan golongan IIIA umumnya memiliki sifat kovalen yang tinggi (ion Al+3 tidak di jumpai dalam ALF3 padat).dalam larutan berair, ion Al+3 berada dalam bentuk ion terhidrat Al (H2O)3+6 atau dalam bentuk kompleks lainnya. Al sangat stabil terhadap udara, karena membentuk lapisan oksida pada permukaannya yang digunakan untuk melindungi logam dari oksidasi lebih lanjut.
3.4 SIFAT KIMIA
3.4.1 Reaksi Dengan Oksigen
Semua unsur logam golongan IIIA hanya bisa bereaksi dengan oksigen pada suhu temperatur ruang atau melalui pemanasan. Reaksi logam IIIA dengan gas oksigen menghasilkan senyawa oksida. Reaksinya :
Al(s) + O2(g) à Al2O3(s)
Ga(s) + O2(g) à Ga2O3(s)
In(s) + O2(g) à In2O3(s)
Berbeda dengan logam golongan IIIA lainnya,Talium bereaksi dengan oksigen menghasilkan TI2O3 yang berwarna hitam coklat akibat terkomposisi menjadi TI2O pada suhu 100 C.Reaksinya :
2TI(s) + 1/2O2(g) à Ti2O(s)
3.4.2 Reaksi dengan Halogen
Semua logam golongan IIIA dapat bereaksi halogen membentuk senyawa trihalida,fluoride,AI,Gad an In adalah ionik ,titik lelehnya tinggi (berturut turut 1290 C),sukar larut dalam air (energi kisinya tinggi); sedangkan klorida,brimida,dan iodidannya mempunyai titik lebih rendah,bersifat kovalen dengan bilangan kordinasi yang bervariasi .
Persamaan umum reaksi antara logam golongan IIIA dengan unsur halogen dapat di tuliskan sebagai berikut:
2M(s) + 3X2(g) à 2MX3(s)
Contoh :
2Al(s) + 3Cl2(g) à 2AlCl3(s)
2Al(s) + 3Br2(l) à 2AlBr3(s)
2Al(s) + 3I2(l) à 2All3(s)
Reaksi diatas juga ditulis sebagai berikut :
2Al(s) + 3I2(l) à 2Al2l6(s)
2Al(s) + 3Cl2(l) à 2Al2Cl3(s)
2Al(s) + 3Br2(l) à 2Al2Br6(s)
3.4.3 Reaksi dengan Hidrogen
Unsur- unsur golongan IIIA tidak dapat membentuk hidrida secara langsung dengan hydrogen. Senyawa hidridi hanya dapat dibentuk melalui reaksi senyawa hidrida dari logam ainnya. Seperti senyawa AIH3 dibuat dengan mereaksikan LiH berlebih dengan AICI3 dalam pelarut eter. Reaksinya.
LiH(l) + AlCl3(l) à (AlH3)n(s) + LiAlH4(s)
Senyawa AlH3 yang di hasilkan ada dalam bentuk polimer (AlH3)n,antara atom Al di hubungkan dengan jembatan hidrogen
3.4.4 Reaksi Dengan Asam
Logam aluminium larut dalam larutan asam baik asam halide seperti HCl maupun asam oksi seperti H2SO4 membentuk larutan yang mengandung ion Al3+ dan gas hidrogen; Reaksinya: 2Al(s) + 3H2SO4(aq) à AI3+(aq) + 2SO42-(aq) + 3H2(g)
2Al(s) + 6HCl(aq) à 2Al3+(aq) + 2SO42-(aq) + 3H2(g)
Gallium tidak dapat bereaksi secara langsung dengan asam,yang dapat bereaksi adalah gallium dalam bentuk senyawa oksidanya(Ge2O3)atau dalam bentuk senyawa basanya (Ge(OH)3). Persamaan reaksi dalam bentuk ionnya sebagai berikut:
Ga2O3(s) + 6H+(aq) à Ga2O3(s) + 3H2(g)
Ga(OH)3(s) + 3H+(aq) à Ga3+(aq) + 3H2O(aq)
Seperti halnya gallium,talium hanya bisa bereaksi dengan asam,dalam bentuk senyawanya.Reaksi ion kalium dari suatu senyawa dengan asam HNO3 15M dan HCl 6M berlangsung sebagai berikut .
In3+(l) + 3HNO3(l) à In(NO)3(s) + 3H+(aq)
In3+(l) + 3HCl(l) à InCl3(s) + 3H+(aq)
3.4.5 Reaksi Dengan Basa
Logam aluminium larut dalam larutan natrium hidroksida menghasilkan ion kompleks tetrahidrokso aluminat. Reaksinya:
2Al(s) + 2NaOH(aq) + 6H2O(l) à 2Na+(aq) + 2[Al(OH)4](aq) + 3H2(g)
Seperti halnya dengan asam,gallium tidak dapat bereaksi secara langsung dengan basa,yang dapat bereaksi dengan basa adalah senyawa galiom oksida dan gallium hidroksida.Reaksi gallium oksida maupun gallium hidroksida dengan basa berlebih menghasilkan senyawa kompleks yang larut dalam air.persamaan reaksi dalam bentuk ionnya:
Ga2O3(s) + 2OH-(aq) à 2Ga(OH)4-(aq)
Ga(OH)3(s) + OH-(aq) à Ga(OH)4-(aq)
Selasa, 24 Maret 2015
 22.03
22.03
 Unknown
Unknown
Menghilangkan Kesadahan
Ada beberapa cara untuk menghilangkan kesadahan air, diantaranya :
1. Pemanasan.
Pemanasan dapat menghilangkan kesadahan sementara.
Pada suhu tinggi, garam hidrogen karbonat Ca(HCO3)2 dapat terurai, sehingga ion Ca2+ akan mengendap sebagai CaCO3. Reaksinya :
Ca(HCO3)2(aq) → CaCO3(s) + CO2(g) + H2O(l)
2. Penambahan ion karbonat.
Soda Na2CO3.10H2O yang ditambahkan dalam air sadah dapat mengendapkan ion Ca+2 menjadi endapan CaCO3. Reaksinya :
Na2CO3.10H2O(s) → 2Na+ (aq) + CO32-(aq) + 10H2O(l)
CaCl2(aq) → Ca+2 (aq) + 2Cl-(aq)
Na2CO3.10H2O(s) + CaCl2(aq) → 2NaCl (aq) + CaCO3(aq) + 10H2O(l)
3. Menggunakan zat pelunak air.
Natrium heksametafosfat [Na2(Na4(PO3))] dapat digunakan untuk menghilangkan air sadah yang mengandung ion Ca2+ dan Mg2+ . Kedua ion ini akan diubah menjadi ion kompleks yang mudah larut sehingga tidak dapat bergabung dengan ion dari sabun.
Na2[Na4(PO3)6](s) → 2Na+ (aq) + [Na4(PO3)6]2-(aq)
CaCl2(aq) → Ca+2 (aq) + 2Cl-(aq)
Na2[Na4(PO3)6](s) + CaCl2(aq) → 2NaCl (aq) + Ca[Na4(PO3)6](aq)
4. Menggunakan resin penukar ion
Resin berfungsi mengikat semua kation atau anion yang ada di dalam air sadah.
2.6 CARA PEMBUATAN
Unsur-unsur logam alkali dapat diperoleh dari senyawanya melalui proses ekstraksi yaitu pemishan suatu unsur dari suatu senyawa. Logam alkali tanah dapat diekstraksi dari senyawanya. Ada dua cara melakukan proses ekstraksi yaitu Metode Reduksi dan Metode Elektrolisis.
1) Ekstraksi Berilium (Be)
Metode Reduksi
Untuk mendapatkan Berilium, bisa didapatkan dengan mereduksi BeF2. Sebelum mendapatkan BeF2, kita harus memanaskan beril [Be3Al2(SiO6)3] dengan Na2SiF6 hingga 700 0C. Karena beril adalah sumber utama berilium.
BeF2(l) + Mg(s) → MgF2 (l) + Be(s)
Metode Elektrolisis
Untuk mendapatkan berilium juga kita dapat mengekstraksi dari lelehan BeCl2 yang telah ditambah NaCl. Karena BeCl2 tidak dapat mengahantarkan listrik dengan baik, sehingga ditambahkan NaCl. Reaksi yang terjadi adalah :
Ionisasi : BeCl2(l) → Be2+ (l) + 2Cl- (l)
Katoda : Be2+ (l) + 2e- → Be (l)
Anoda : 2Cl-(l) → Cl2(g) + 2e-
BeCl2(l) → Be (l) + Cl2(g)
2) Ekstraksi Magnesium (Mg)
Metode Reduksi
Untuk mendapatkan magnesium kita dapat mengekstraksinya dari dolomit [MgCa(CO3)2] karena dolomite merupakan salah satu sumber yang dapat menhasilkan magnesium. Dolomite dipanaskan sehingga terbentuk MgO.CaO. lalu MgO.CaO. dipanaskan dengan FeSi sehingga menghasilkan Mg. Reaksinya
[MgCa(CO3)2 ](s) → MgO.CaO(s) + CO2(g)
2[MgO.CaO](s) + FeSi(s) → 2Mg(s) + Ca2SiO4(s) + Fe(s)
Metode Elektrolisis
Selain dengan ekstraksi dolomite magnesium juga bisa didapatkan dengan mereaksikan air alut dengan CaO. Reaksi yang terjadi :
CaO(s) + H2O(l) → Ca2+ (aq) + 2OH- (aq)
Ion OH- yang dihasilkan kemudian bereaksi dengan ion Mg2+ yang ada didalam air laut . Reaksinya:
Mg2+(aq) + 2OH(aq)- → Mg(OH)2(s)
Selanjutnya Mg(OH)2 direaksikan dengan HCl Untuk membentuk MgCl2
Mg(OH)2(s) + 2HCl(l) → MgCl2(l) + 2H2O(l)
Setelah mendapatkan lelehan MgCl2 kita dapat mengelektrolisisnya untuk mendapatkan magnesium. Reksinya :
Ionisasi : MgCl2(l) → Mg2+(l) + 2Cl-(l)
Katode : Mg2+(l) + 2e- → Mg(s)
Anode : 2Cl-(l) → Cl2(g) + 2e-
MgCl2(l) → Mg(s) + Cl2(g)
3) Ekstraksi Kalsium (Ca)
Metode Elektrolisis
Batu kapur (CaCO3) adalah sumber utama untuk mendapatkan kalsium (Ca). Untuk mendapatkan kalsium, kita dapat mereaksikan CaCO3 dengan HCl agar terbentuk senyawa CaCl2. Reaksi yang terjadi :
CaCO3(s) + 2HCl(l) → CaCl2(l) + H2O(l) + CO2(g)
Setelah mendapatkan CaCl2, kita dapat mengelektrolisisnya agar mendapatkan kalsium (Ca). Reaksi yang terjadi :
Ionisasi ; CaCl2(l) → Ca+2(l) + 2Cl-(l)
Katoda ; Ca+2(l) + 2e- → Ca(s)
Anoda ; 2Cl-(l) → Cl2(g) + 2e-
CaCl2(l) → Ca(s) + Cl2(g)
Metode Reduksi
Logam kalsium (Ca) juga dapat dihasilkan dengan mereduksi CaO oleh Al atau dengan mereduksi CaCl2 oleh Na.
Reduksi CaO oleh Al : 6CaO(s) + 2Al(s) → 3Ca + Ca3Al2O6(s)
Reduksi CaCl2 oleh Na : CaCl2(l) + 2Na(s) → Ca(s) + 2NaCl(s)
4) Ekstraksi Strontium (Sr)
Metode Elektrolisis
Untuk mendapatkan Strontium (Sr), Kita bisa mendapatkannya dengan elektrolisis lelehan SrCl2. Lelehan SrCl2 bisa didapatkan dari senyawa selesit [SrSO4]. Karena Senyawa selesit merupakan sumber utama Strontium (Sr). Reaksi yang terjadi ;
Ionisasi : SrCl2(l) → Sr2+(l) + 2Cl-(l)
Katode : Sr2+(l) + 2e- → Sr(s)
Anoda : 2Cl-(l) → Cl2(g) + 2e-
SrCl2(l) → Sr(s) + Cl2(g)
5) Ekstraksi Barium (Ba)
Metode Elektrolisis
Barit (BaSO4) adalah sumber utama untuk memperoleh Barium (Ba). Setelah diproses menjadi BaCl2 barium bisa diperoleh dari elektrolisis lelehan BaCl2. Reaksi yang terjadi :
Ionisasi : BaCl2(l) → Ba2+(l) + 2Cl-(l)
Katoda : Ba2+(l) + 2e- → Ba(s)
Anoda : 2Cl-(l) → Cl2(g) + 2e-
BaCl2(l) → Ba(s) + Cl2(g)
Metode Reduksi
Selain dengan elektrolisis, barium bisa kita peroleh dengan mereduksi BaO oleh Al. Reaksi yang terjadi :
6BaO + 2Al → 3Ba + Ba3Al2O6.
2.7 MANFAAT LOGAM DAN SENYAWA LOGAM ALKALI TANAH
2.7.1 Manfaat Berilium (Be) dan Senyawanya
Logam Berilium memiliki beberapa manfaat, diantaranya :
a. Berilium digunakan untuk memadukan logam agar lebih kuatakan tetap bermasa lebih ringan. Biasanya paduan inidigunakan pada kemudi pesawat Zet.
b. Berilium digunakan pada kaca dari sinar X.
c. Berilium digunakan untuk mengontrol reaksi fisi pada reaktor nuklir
d.Campuran berilium dan tembaga banyak dipakai pada alatlistrik, maka Berilium sangat penting sebagai komponentelevisi.
2.7.2 Manfaat Magnesium (Mg) dan Senyawanya
a. Magnesium digunakan untuk memberi warna putih terang padakembang api dan pada lampu Blitz.
b. Senyawa MgO dapat digunakan untuk melapisi tungku, karenasenyawa MgO memiliki titik leleh yang tinggi.
c. Senyawa Mg(OH)2digunakan dalam pasta gigi untuk mengurangi asam yang terdapat di mulut dan mencagahterjadinnya kerusakan gigi, sekaligus sebagai pencegah maag.
2.7.3 Manfaat Kalsium (Ca) dan Senyawanya
a. Kalsium digunakan pada obat obatan, bubuk pengembang kuedan plastik.
b. SenyawaCaSO4 digunakan untuk membuat Gips yang berfungsiuntuk membalut tulang yang patah.
c. Senyawa CaCO3biasa digunakan untuk bahan bangunan sepertikomponen semen dan cat tembok.Selain itu digunakan untuk membuat kapur tulis dan gelas.
d. Kalsium Oksida (CaO) dapat mengikat air pada Etanol karena bersifat dehidrator,dapat juga mengeringkan gas dan mengikatKarbondioksida pada cerobong asap.
e. Ca(OH2 digunakan sebagai pengatur pH air limbah dan jugasebagai sumber basa yang harganya relatif murah.
f. Kalsium Karbida (CaC2) disebut juga batu karbit merupakan bahan untuk pembuatan gas asetilena (C2H2) yang digunakan untuk pengelasan.
g. Kalsium banyak terdapat pada susu dan ikan teri yang berfungsisebagai pembentuk tulang dan gigi.
2.7.4 Manfaat Stronsium (Sr) dan Senyawanya
a. Stronsium dalam senyawa Sr(NO3)2 memberikan warna merah apabila digunakan untuk bahan kembang api.
b. Stronsium sebagai senyawa karbonat biasa digunakan dalam pembuatan kaca televise berwarna dan computer
c. Untuk pengoprasian mercusuar yang mengubah energi panas menjadi listrik dalam batrai nuklir RTG (Radioisotop Thermoelectric Generator)
2.7.5 Manfaat Barium (Ba) dan Senyawanya
a. BaSO4 digunakan untuk memeriksa saluran pencernaan karenamampu menyerap sinar X meskipun beracun.
b. BaSO4 digunakan sebagai pewarna pada plastik karena memiliki kerapatan yang tinggi dan warna terang.
c. Ba(NO3)2 digunakan untuk memberikan warna hijau pada kembang api
BAB III
LOGAM GOLONGAN IIIA (GOLONGAN ALUMUNIUM)
3.1 PENDAHULUAN
Unsur-unsur pada golongan IIIA menunjukkan perbedaan sifat yang cukup bervariasi. Boron merupakan unsur nonlogam, alumunium merupakan unsur logam namun menunjukkan banyak kemiripan sifat kimia dengan boron dan unsur sisanya seluruhnya memiliki karakteristik sebagai unsur logam (Sharpe, 1992).
Meskipun keadaan oksidasi positif tiga (+3) merupakan karakteristik utama untuk semua unsur golongan IIIA, namun keadaan positif satu (+1 atau + saja) terdapat dalam senyawaan kimia semua unsur golongan IIIA kecuali boron, dan untuk thallium keadaan tersebut merupakan keadaan oksidasi yang stabil
3.2 SIFAT FISIKA
Alumunium murni merupakan logam berwarna putih keperakan dengan banyak karakteristik yang diperlukan. Sedangkan gallium sangat sulit ditemukan dalam keadaan melainkan hanya bias ditemukan sebagai biji gallium yang terdapat bersama-sama logam-logam yang lain. Sementara itu indium merupakan logam yang jarang ditemukan, sangat lembut, berwarna putih keperakan dan stabil didalam udara dan air tetapi larut dalam asam.
Pada tabel 3.1 berikut ini disajikan ringkasan beberapa sifat penting dari unsur-unsur golongan IIIA.
Tabel 3.1 Sifat Fisika Unsur-unsur logam golongan IIIA
| Unsur | Aluminium | Galium | Indium | Talium |
| Kerapatan (g/cm3) | 2,70 | 5,90 | 7,30 | 11,85 |
| Titik Leleh ( oC) | 659 | 30 | 156 | 304 |
| Titik Didih ( oC) | 2447 | 2237 | 2047 | 1467 |
Pada tabel diatas tampak sesuai dengan massa atomnya, dari aluminium ke talium yang makin besar, maka kerapatan atom massa jenis talium (11,85 g/mL) > indium (7,30 g/mL) > gallium (5,90 g/mL) > alumunium (2,70g.mL).
Seperti halnya pada unsur logam golongan alkali (golongan IA), maka titik didih unsur logam golongan IIIA sangat dipengaruhi oleh kekuatan ikatan logam sehingga titik didihnya dari alumunium ke gallium kemudian ke indium dan talium semakin kecil.
Namun pada titik leleh unsur logam golongan IIIA terjadi anomaly. Massa atom dan massa jenis alumunium < galium < indium < talium. Demikian juga dengan jari-jari atom alumunium < gallium < indium < talium. Jika titik leleh sangat dipengaruhi oleh massa atom seharusnya titik leleh aluminium paling rendah dan titik leleh talium paling rendah. Tetapi faktanya, titiki leleh aluminium dan titik leleh gallium paling rendah. Ini kemungkinan yang sangat berpengaruh terhadap titik leleh aluminium ikatan logam. Sedangakan pada gallium, indium dan talium yang palinng berpegaruh adalah massa jenis. Oleh karena itu titik leleh < gallium < indium <talium.
3.3 SIFAT PERIODIK
Seperti halnya logam alkali dan alkali tanah, sifat periodik dan sifat kimia logam golongan IIIA sangat di tentukan oleh konfigurasi elektronnya yang memeliki tiga elektron pada kulit terluarnya. Perbedaan sifat unsur yang satu dengan yang lain menunjukan keteraturan, seperti terlihat pada tabel di bawah tabel 3.2 di bawah ini. Pada tabel tersebut tampak kecenderungan sifat logam golongan IIIA sebagai berikut ::
· Jari jari atom cenderung bertambah besar dari Ga ke Tl, kecuali jari jari atom logam Al lebih besar dari pada Ga.
· Energi ionisasi pertama cenderung makin kecil dari Al ke Tl
· Keelektronegatifan cenderung bertambah dari Al ke Tl
Tabel 3.2 Sifat Periodik logam golongan IIIA
| Unsur | Konfigurasi Elektron | Jari-jari Atom (Å) | Energi Ionisasi (Kj/mol) | Keelektronega tifan | Potensial Reduksi (Volt) |
| 13Al | [Ne] 3s23p1 | 1,25 | 577 | 1,5 | -1,66 |
| 31Ga | [Ar] 4s24p1 | 1,24 | 579 | 1,6 | -0,56 |
| 49In | [Kr] 5s25p1 | 1,50 | 556 | 1,7 | -0,34 |
| 81Ti | [Xe] 6s26p1 | 1,55 | 590 | 1,8 | +0,72 |
Potensial reduksi berhaga negatif menyatakan bahwa unsur lebih mudah melepaskan dari pada menerima elektron karena melepaskan elektron merupakan sifat khas dari pada logam. Aluminium memiliki potensial reduksi negatif yang paling besar di antara kation golongan IIIA.
Ini menunjukan bahwa Al adalah logam yang paling aktif berubah menjadi Al+3. Energi ionisasi logam golongan IIIA hamper sama satu sama lain, kecuali energi hidrasi Al+3. merupakan yang terbesar diantara kation golongan IIIA.
Ada sifat menarik dari unsur Ga,In,dan Tl yang tidak terdapat pada Al,yaitu kemampuannya membentuk ion bermuatan satu. Kemampuan ini menunjukan adanya pasangan elektron lembam, nS2 ,dalam unsur paska peralihan (Post-transition). Jadi, sebuah atom Ga dapat kehilangan elektron pada 4P dan mempertahankan 4s untuk membentuk ion Ga+, dengan dangan konsfigurasi elektron [Ar]3d104s2. Kemungkinan ini lebih mudah terjadi pada atom yang lebih berat dalam golongan. Dalam kenyataannya, kalium dengan bilangan oksidasi +1lebih mantap dalam larutan berair dibanding kalium dengan bilangan oksidasi+3.
Ukuran ion yang kecil dan muatan ion yang besar (+3) serta tingginya energi ionisasi menyebabkan golongan IIIA umumnya memiliki sifat kovalen yang tinggi (ion Al+3 tidak di jumpai dalam ALF3 padat).dalam larutan berair, ion Al+3 berada dalam bentuk ion terhidrat Al (H2O)3+6 atau dalam bentuk kompleks lainnya. Al sangat stabil terhadap udara, karena membentuk lapisan oksida pada permukaannya yang digunakan untuk melindungi logam dari oksidasi lebih lanjut.
3.4 SIFAT KIMIA
3.4.1 Reaksi Dengan Oksigen
Semua unsur logam golongan IIIA hanya bisa bereaksi dengan oksigen pada suhu temperatur ruang atau melalui pemanasan. Reaksi logam IIIA dengan gas oksigen menghasilkan senyawa oksida. Reaksinya :
Al(s) + O2(g) à Al2O3(s)
Ga(s) + O2(g) à Ga2O3(s)
In(s) + O2(g) à In2O3(s)
Berbeda dengan logam golongan IIIA lainnya,Talium bereaksi dengan oksigen menghasilkan TI2O3 yang berwarna hitam coklat akibat terkomposisi menjadi TI2O pada suhu 100 C.Reaksinya :
2TI(s) + 1/2O2(g) à Ti2O(s)
Minggu, 15 Maret 2015
 19.55
19.55
 Unknown
Unknown
2.4.1 Kereaktifan Logam Alkali Tanah
Alkali tanah termasuk logam yang reaktif, namun berilium adalah satu-satunya unsur alkali tanah yang kurang reaktif, bahkan tidak bereaksi dengan air. Logam alkali tanah bersifat pereduksi (oksidator) kuat. Dari berilium ke barium sifat pereduksi ini semakin kuat. Hal ini ditunjukkan oleh kemampuan bereaksi dengan air yang semakin meningkat dari berilium ke barium. Selain dengan air, unsur logam alkali tanah juga bisa bereaksi dengan oksige, nitrogen, dan halogen.
Tabel 2.3 Kereaktifan logam-logam alkali tanah
| Reaksi secara umum | Keterangan |
| 2M(s) + O2(g) → 2MO(s) | Reaksi selain Be dan Mg tak perlu pemanasan |
| M(s) + O2(g) → MO2(s) | Ba mudah, Sr dengan tekanan tinggi, Be, Mg dan Ca tidak dapat bereaksi |
| M(s) + X2(g) → MX2(s) | X, F, Cl, Br dan I |
| M(s) + 2H2O(l) → M(OH)2(aq) + H2(g) | Be tidak dapat, Mg perlu pemanasan |
| 3M(s) + N2(g) → M3N2(s) | Reaksi berlangsung pada suhu tinggi, Be tidak dapat berlangsung |
| M(s) + 2H+(aq) → M2+(aq) + H2(g) | Reaksi cepat berlangsung |
| M(s) + H2(g) → MH2(s) | Perlu pemanasan, Be dan Mg dapat berlangsung |
A. Reaksi Logam Alkali Tanah Dengan Air
Berilium tidak dapat bereaksi dengan air sekalipun dengan air panas. Sedangkan logam magnesium dapat bereaksi tetapi sangat lambat dan hanya dapat bereaksi dengan air panas. Logam kalsium, stronsium, barium, dan radium dapat bereaksi sangat cepat dengan air pada temperatur ruang bahkan dapat bereaksi meskipun dengan air dingin. Contoh reaksi logam alakali tanah dan air berlangsung sebagai berikut :
Mg(s) + 2H2O(l) à Mg (OH)2(aq) + H2(g) Sangat lambat
Ca(s) + 2H2O(l) à Ca(OH)2(aq) + H2(g) Cepat
Sr(s) + 2H2O(l) à Sr(OH)2(aq) + H2(g) Sangat cepat
Ba(s) + 2H2O(l) à Ba(OH)2(aq) + H2(g) Paling cepat
B.Reaksi Logam Alkali Tanah Dengan Gas Oksigen
Semua logam alkali tanah dapat bereaksi demngan oksigen menghasilkan senyawa oksida.Tetapi berilium dan magnesium hanya dapat bereaksi dengan oksigen dengan pemanasan. Oksida berilium dan magnesium yang terbentuk akan menjadi lapisan pelindung pada permukaan logam dibawahnya. Stronsium dan barium dapat bereaksi dengan oksigen pada suhu ruangan bahkan barium dapat membentuk senyawa peroksida (BaO2).Contoh reaksi logam alkali tanah dengan oksigen:
2Be(s) + O2(g) à 2BeO(s) Bereaksi jika dipanaskan
2Mg(s) + O2(g) à 2MgO(s) Bereaksi jika dipanaskan
2Ca(s) + O2(g) à 2CaO(s) Bereaksi cepat tanpa pemanasan
2Sr(s) + O2(g) à 2SrO(s) Bereaksi sangat cepat tanpa pemanasan
2Ba(s) + O2(g) à 2BaO(s) Bereaksi paling cepat tanpa pemanasan
Ba(s) + O2(g) berlebihan à BaO2(s) Bereaksi cepat tanpa pemanasan
C.Reaksi Logam Alkali Tanah Dengan Gas Nitrogen
Logam alkali tanah yang terbakar diudara,selain bereaksi dengan oksigen membentuk senyawa oksida, juga dapat bereaksi dengan nitrogen membentuk senyawa nitrida. Contoh,pembakaran magnesium di udara pada suhu tinggi menghasilkan: Magnesium oksida dan Magnesium nitrid (Mg3N2). Reaksinya :
2Mg(s) + 1/2O2(g) + N2(g) à MgO(s) + Mg3N2(s)
Bila Mg3N2 direaksikan dengan air maka akan di dapatkan gas NH3
Mg3N2(s) + 6H2O(l) à 3Mg(OH)2(s) + 2NH3(g)
D.Reaksi Logam Alkali Tanah Dengan Gas Hidrogen
Kalsium,stronsium dan barium memerlukan pemanasan untuk dapat bereaksi dengan gas hidrogen. Sedangkan berilium dan magnesium tidak dapat bereaksi dengan gas hidrogen sekalipun dengan pemanasan.
Reaksi kalsium,stronsium dan barium dengan gas hidrogen :
Ca(s) + H2(g) à 2CaH2 (s) Bereaksi dengan pemanasan
Sr(s) + H2(g) à 2SrH2 (s) Bereaksi dengan pemanasan
Ba(s) + H2(g) à 2BaH2 (s) Bereaksi dengan pemanasan
E.Reaksi Logam Alkali Tanah Dengan Unsur Halogen
Hampir semua logam alkali tanah bereaksi dengan halogen secara cepat membentuk garam halida, kecuali berilium karena daya polarisasi ion Be2+ sangat rendah maka berilium berikatan kavalen dengan unsur halogen,kecuali dengan flour. Sedangkan logam alkali tanah yang lain dengan unsur halogen berikatan ion. Reaksinya
Be(s) + Cl2(g) à BeCl2 (s) Senyawa BeCl2 berikatan kovalen
Mg(s) + Cl2(g) àMgCl2 (s) Senyawa MgCl2 berikatan ion
Ca(s) + Cl2(g) à CaCl2 (s) Senyawa CaCl2 berikatan ion
Sr(s) + Cl2(g) à SrCl2 (s) Senyawa SrCl2 berikatan ion
Ba(s) + Cl2(g) à BaCl2 (s) Senyawa BaCl2 berikatan ion
2.4.2 Warna Nyala Logam Alkali Tanah
Logam alkali dan alkali tanah memberikan warna nyala yang khas,warna nyala dari logam alkali tanah dapat digunakan sebagai salah satu cara mengindentifikasi adanya unsur logam alkali dan alkali tanah dalam suatu bahan. Salah satu ciri khas dari suatu unsur ialah spectrum emesinya. Spektrum emisi teramati sebagai pancaran cahaya dengan warna tertentu,tapi sesungguhnya spectrum itu terdiri atas beberapa garis warna yang khas bagi setiap unsur.
| Unsur | Li | Na | K | Rb | Cs |
| Warna Nyala Api | Merah | Kuning atau Jingga | Ungu atau Lila | Biru Kemerahan | Biru |
| Unsur | Be | Mg | Ca | Sr | Ba |
| Warna Nyala Api | - | Putih | Jingga Kemerahan | Merah | Hijau |
Tes Nyala atau reaksi nyala digunakan untuk mengindentifikasi keberadaan ion logam dalam jumlah yang relatif kecil dalam sebuah senyawa.Tidak semua ion logam menghasilkan warna nyala. Untuk warna nyala unsur-unsur logam alkali dan alkali tanah,uji nyalah merupaka cara yang paling mudah untuk mengindentifikasi logam mana yang terdapat dalam suatu senyawa.
Warana nyala dihasilkan dari pergerakan atau perpindahan elektron dalam ion-ion logam yang terdapat dalam senyawa. Masing-masing perpindahan elektron ini melibatkan sejumlah energi tertentu yang dilepaskan sebagai cahaya dengan energi dan warna tertentu. Akibat dari semua perpindahan elektron maka dapat dihasilkan sebuah spectrum garis yang berwarna. Besarnya energi perpindahan elektron bervariasi dari satu ion logam ke ion logam lainnya.ini bearti bahwa setiap logam yang berbeda akan memiliki pola garis-garis spectra dan warna nyala yangh berbeda pula.
2.5 KESADAHAN AIR
Keberadaan ion-ion logam golongan alkali tanah khususnya ion Ca2+ dan Mg2+ menyebabkan kesadaan air. Selain ion kalsium dan magnesium,penyebab kesadahan juga bisa merupakan ion logam lain maupungaram-garam bikarbonat dan sulfat.Air yang telah mengalami kesadahan air inidapat di lihat ketika sedang mencuci menggunakan deterjan yakni deterjen tidak dapat menimbulkan busa pada saat di gunakan dalam air yang telah mengalami kesadahan.Oleh karena itu dalam kehidupan sehari-hari di kenal adanya dua jenis air yaitu :
1) Air Lunak
Air lunak merupakan air dalam kehidupan sehari-hari yang dapat menghasilkan cukup banyak busa ketika deterjen atau sabun di gunakan untuk mencuci menggunakan air tersebut. Air lunak adalah air yang mengandung kadar mineral yang rendah
2) Air Sadah (Hard Water)
Air sadah merupakan air yang hanya menghasilkan sedikit busa bahkan tidak menghasilkan sama sekali busa,jika air tersebut di gunakan untuk mencuci menggunakan sabun atau deterjen. Air sadah adalah air yang mengandung kadar mineral yang sangat tinggi. Secara fisik air sadah biasanya terlihat keruh.
Air sadah dapat digolongkan menjadi dua jenis,berdasarkan jenis anion yang diikat oleh kation (Ca2+ atau Mg2+),yaitu air sadah sementara dan air sadah tetap.
Air sadah sementara yaitu air yang mengandung garam hidrogen karbonat (Ca(HCO3)2 dan Mg(HCO3)2. Senyawa Ca(HCO3)2 dan Mg(HCO3)2 dapat terbentuk dari batu kapur (CaCO3) dan dolomite yang bereaksi dengan gas CO2 yang larut dalam air. Reaksinya :
CaCO3(s) + 2H2O(l) + CO2(g) → Ca(HCO3)2(s)
Garam garam penyebab kesadaan air dalam air sadah sementara dapat di hilangkan dengan cara pemanasan dan penyaringan.Karena ketika air yang mengandung garam garam tersebut di panaskan maka akan terjadi reaksi :
Ca(HCO3)2(s) → CaO(s) + H2O(gl) + CO2(g)
Mg(HCO3)2(s) → MgO(s) + H2O(gl) + CO2(g)
Berdasarkan persamaan reaksi tersebut,maka senyawa H2O(gl) dan CO2(g) menguap ke udara sedangkan senyawa CaO(s) dan MgO(s) mengendap ke bawah. Oleh karena itu air yang di atas senyawa CaO(s) dan MgO(s) tersebut,yang semula merupakan air sadah sementara setelah di panaskan akan berubah menjadi air lunak karena kandungan garam garam Ca(HCO3)2dan Mg(HCO3)2 tidak ada lagi.
Air sadah tetap yaitu air yang mengandung garam selain garam hidrogen karbonat,seperti garam sulfat(CaSO4, MgSO4) dan garam klorida (CaCI2, MgCI2). Air sadah tetap tidak dapat di hilangakan dengan pemanasan, tetapi harus di tambahkan natrium karbonat (soda), karena penambahan senyawa tersebut akan menyebabkan terjadinya reaksi sebagai berikut :
MgCl2(aq) + Na2CO3(aq) → MgCO3(s) + 2NaCl(aq)
CaCl2(aq) + Na2CO3(aq) → CaCO3(s) + 2NaCl(aq)
Berdasarkan persamaan reaksi tersebut maka MgCO3(s) dan CaCo3(s) mengendap ke bawah. Oleh karena itu air yang ada di atas senyawa tersebut,yang semula merupakan air sadah tetap setelah ditambahkan senyawa soda akan berubah menjadi air lunak karena kandungan garam-garam (CaCl2, MgCl2) tidak ada lagi.
Air sadah kurang baik apa bila di gunakan untuk mencuci dengan menggunakan sabun (NaC17H35COO). Hal ini disebabkan ion Ca2+ atau Mg2+ dalam air sadah dapat mengendapkan sabun sehingga membentuk endapan minyak yang terapung dipermukaan air. Dengan demikian sabun hanya menghasilkan sedikit busa dan daya pembersih kurang.
Reaksi ion Ca2+ dan Mg2+ dengan sabun :
2NaC17H35COO(aq) + Ca2+ → CaH35COO)2(s) + 2Na+ (aq)
Walaupun tidak berbahaya, air sadah dapat menimbulkan beberapa kerugian diantaranya:
1. Efisiensi air dapat menurunkan efisiensi kerja deterjen dan sabun
2. Kesadahan air dapat menyebabkan noda pada bahan pecah belah
3. Kesadahan air dapat menyebabkan bahan linen beruba pucat
4. Mineral kesadahan air dapat menyumbat saluran air
5. Residu kesadahan air dapat melapisi elemen pemanas dan menurunkan efisiensi panas
6. Kesadahan air dapat merusak shower dan bathtubs
Menghilangkan Kesadahan
Ada beberapa cara untuk menghilangkan kesadahan air, diantaranya :
1. Pemanasan.
Pemanasan dapat menghilangkan kesadahan sementara.
Pada suhu tinggi, garam hidrogen karbonat Ca(HCO3)2 dapat terurai, sehingga ion Ca2+ akan mengendap sebagai CaCO3. Reaksinya :
Ca(HCO3)2(aq) → CaCO3(s) + CO2(g) + H2O(l)
2. Penambahan ion karbonat.
Soda Na2CO3.10H2O yang ditambahkan dalam air sadah dapat mengendapkan ion Ca+2 menjadi endapan CaCO3. Reaksinya :
Na2CO3.10H2O(s) → 2Na+ (aq) + CO32-(aq) + 10H2O(l)
CaCl2(aq) → Ca+2 (aq) + 2Cl-(aq)
Na2CO3.10H2O(s) + CaCl2(aq) → 2NaCl (aq) + CaCO3(aq) + 10H2O(l)
3. Menggunakan zat pelunak air.
Natrium heksametafosfat [Na2(Na4(PO3))] dapat digunakan untuk menghilangkan air sadah yang mengandung ion Ca2+ dan Mg2+ . Kedua ion ini akan diubah menjadi ion kompleks yang mudah larut sehingga tidak dapat bergabung dengan ion dari sabun.
Na2[Na4(PO3)6](s) → 2Na+ (aq) + [Na4(PO3)6]2-(aq)
CaCl2(aq) → Ca+2 (aq) + 2Cl-(aq)
Na2[Na4(PO3)6](s) + CaCl2(aq) → 2NaCl (aq) + Ca[Na4(PO3)6](aq)
4. Menggunakan resin penukar ion
Resin berfungsi mengikat semua kation atau anion yang ada di dalam air sadah.
2.6 CARA PEMBUATAN
Unsur-unsur logam alkali dapat diperoleh dari senyawanya melalui proses ekstraksi yaitu pemishan suatu unsur dari suatu senyawa. Logam alkali tanah dapat diekstraksi dari senyawanya. Ada dua cara melakukan proses ekstraksi yaitu Metode Reduksi dan Metode Elektrolisis.
1) Ekstraksi Berilium (Be)
Metode Reduksi
Untuk mendapatkan Berilium, bisa didapatkan dengan mereduksi BeF2. Sebelum mendapatkan BeF2, kita harus memanaskan beril [Be3Al2(SiO6)3] dengan Na2SiF6 hingga 700 0C. Karena beril adalah sumber utama berilium.
BeF2(l) + Mg(s) → MgF2 (l) + Be(s)
Metode Elektrolisis
Untuk mendapatkan berilium juga kita dapat mengekstraksi dari lelehan BeCl2 yang telah ditambah NaCl. Karena BeCl2 tidak dapat mengahantarkan listrik dengan baik, sehingga ditambahkan NaCl. Reaksi yang terjadi adalah :
Ionisasi : BeCl2(l) → Be2+ (l) + 2Cl- (l)
Katoda : Be2+ (l) + 2e- → Be (l)
Anoda : 2Cl-(l) → Cl2(g) + 2e-
BeCl2(l) → Be (l) + Cl2(g)
2) Ekstraksi Magnesium (Mg)
Metode Reduksi
Untuk mendapatkan magnesium kita dapat mengekstraksinya dari dolomit [MgCa(CO3)2] karena dolomite merupakan salah satu sumber yang dapat menhasilkan magnesium. Dolomite dipanaskan sehingga terbentuk MgO.CaO. lalu MgO.CaO. dipanaskan dengan FeSi sehingga menghasilkan Mg. Reaksinya
[MgCa(CO3)2 ](s) → MgO.CaO(s) + CO2(g)
2[MgO.CaO](s) + FeSi(s) → 2Mg(s) + Ca2SiO4(s) + Fe(s)
Metode Elektrolisis
Selain dengan ekstraksi dolomite magnesium juga bisa didapatkan dengan mereaksikan air alut dengan CaO. Reaksi yang terjadi :
CaO(s) + H2O(l) → Ca2+ (aq) + 2OH- (aq)
Ion OH- yang dihasilkan kemudian bereaksi dengan ion Mg2+ yang ada didalam air laut . Reaksinya:
Mg2+(aq) + 2OH(aq)- → Mg(OH)2(s)
Selanjutnya Mg(OH)2 direaksikan dengan HCl Untuk membentuk MgCl2
Mg(OH)2(s) + 2HCl(l) → MgCl2(l) + 2H2O(l)
Setelah mendapatkan lelehan MgCl2 kita dapat mengelektrolisisnya untuk mendapatkan magnesium. Reksinya :
Ionisasi : MgCl2(l) → Mg2+(l) + 2Cl-(l)
Katode : Mg2+(l) + 2e- → Mg(s)
Anode : 2Cl-(l) → Cl2(g) + 2e-
MgCl2(l) → Mg(s) + Cl2(g)
3) Ekstraksi Kalsium (Ca)
Metode Elektrolisis
Batu kapur (CaCO3) adalah sumber utama untuk mendapatkan kalsium (Ca). Untuk mendapatkan kalsium, kita dapat mereaksikan CaCO3 dengan HCl agar terbentuk senyawa CaCl2. Reaksi yang terjadi :
CaCO3(s) + 2HCl(l) → CaCl2(l) + H2O(l) + CO2(g)
Setelah mendapatkan CaCl2, kita dapat mengelektrolisisnya agar mendapatkan kalsium (Ca). Reaksi yang terjadi :
Ionisasi ; CaCl2(l) → Ca+2(l) + 2Cl-(l)
Katoda ; Ca+2(l) + 2e- → Ca(s)
Anoda ; 2Cl-(l) → Cl2(g) + 2e-
CaCl2(l) → Ca(s) + Cl2(g)
Metode Reduksi
Logam kalsium (Ca) juga dapat dihasilkan dengan mereduksi CaO oleh Al atau dengan mereduksi CaCl2 oleh Na.
Reduksi CaO oleh Al : 6CaO(s) + 2Al(s) → 3Ca + Ca3Al2O6(s)
Reduksi CaCl2 oleh Na : CaCl2(l) + 2Na(s) → Ca(s) + 2NaCl(s)
4) Ekstraksi Strontium (Sr)
Metode Elektrolisis
Untuk mendapatkan Strontium (Sr), Kita bisa mendapatkannya dengan elektrolisis lelehan SrCl2. Lelehan SrCl2 bisa didapatkan dari senyawa selesit [SrSO4]. Karena Senyawa selesit merupakan sumber utama Strontium (Sr). Reaksi yang terjadi ;
Ionisasi : SrCl2(l) → Sr2+(l) + 2Cl-(l)
Katode : Sr2+(l) + 2e- → Sr(s)
Anoda : 2Cl-(l) → Cl2(g) + 2e-
SrCl2(l) → Sr(s) + Cl2(g)
5) Ekstraksi Barium (Ba)
Metode Elektrolisis
Barit (BaSO4) adalah sumber utama untuk memperoleh Barium (Ba). Setelah diproses menjadi BaCl2 barium bisa diperoleh dari elektrolisis lelehan BaCl2. Reaksi yang terjadi :
Ionisasi : BaCl2(l) → Ba2+(l) + 2Cl-(l)
Katoda : Ba2+(l) + 2e- → Ba(s)
Anoda : 2Cl-(l) → Cl2(g) + 2e-
BaCl2(l) → Ba(s) + Cl2(g)
Metode Reduksi
Selain dengan elektrolisis, barium bisa kita peroleh dengan mereduksi BaO oleh Al. Reaksi yang terjadi :
6BaO + 2Al → 3Ba + Ba3Al2O6.
2.7 MANFAAT LOGAM DAN SENYAWA LOGAM ALKALI TANAH
2.7.1 Manfaat Berilium (Be) dan Senyawanya
Logam Berilium memiliki beberapa manfaat, diantaranya :
a. Berilium digunakan untuk memadukan logam agar lebih kuatakan tetap bermasa lebih ringan. Biasanya paduan inidigunakan pada kemudi pesawat Zet.
b. Berilium digunakan pada kaca dari sinar X.
c. Berilium digunakan untuk mengontrol reaksi fisi pada reaktor nuklir
d.Campuran berilium dan tembaga banyak dipakai pada alatlistrik, maka Berilium sangat penting sebagai komponentelevisi.
2.7.2 Manfaat Magnesium (Mg) dan Senyawanya
a. Magnesium digunakan untuk memberi warna putih terang padakembang api dan pada lampu Blitz.
b. Senyawa MgO dapat digunakan untuk melapisi tungku, karenasenyawa MgO memiliki titik leleh yang tinggi.
c. Senyawa Mg(OH)2digunakan dalam pasta gigi untuk mengurangi asam yang terdapat di mulut dan mencagahterjadinnya kerusakan gigi, sekaligus sebagai pencegah maag.
2.7.3 Manfaat Kalsium (Ca) dan Senyawanya
a. Kalsium digunakan pada obat obatan, bubuk pengembang kuedan plastik.
b. SenyawaCaSO4 digunakan untuk membuat Gips yang berfungsiuntuk membalut tulang yang patah.
c. Senyawa CaCO3biasa digunakan untuk bahan bangunan sepertikomponen semen dan cat tembok.Selain itu digunakan untuk membuat kapur tulis dan gelas.
d. Kalsium Oksida (CaO) dapat mengikat air pada Etanol karena bersifat dehidrator,dapat juga mengeringkan gas dan mengikatKarbondioksida pada cerobong asap.
e. Ca(OH2 digunakan sebagai pengatur pH air limbah dan jugasebagai sumber basa yang harganya relatif murah.
f. Kalsium Karbida (CaC2) disebut juga batu karbit merupakan bahan untuk pembuatan gas asetilena (C2H2) yang digunakan untuk pengelasan.
g. Kalsium banyak terdapat pada susu dan ikan teri yang berfungsisebagai pembentuk tulang dan gigi.
2.7.4 Manfaat Stronsium (Sr) dan Senyawanya
a. Stronsium dalam senyawa Sr(NO3)2 memberikan warna merah apabila digunakan untuk bahan kembang api.
b. Stronsium sebagai senyawa karbonat biasa digunakan dalam pembuatan kaca televise berwarna dan computer
c. Untuk pengoprasian mercusuar yang mengubah energi panas menjadi listrik dalam batrai nuklir RTG (Radioisotop Thermoelectric Generator)
2.7.5 Manfaat Barium (Ba) dan Senyawanya
a. BaSO4 digunakan untuk memeriksa saluran pencernaan karenamampu menyerap sinar X meskipun beracun.
b. BaSO4 digunakan sebagai pewarna pada plastik karena memiliki kerapatan yang tinggi dan warna terang.
c. Ba(NO3)2 digunakan untuk memberikan warna hijau pada kembang api
 19.46
19.46
 Unknown
Unknown
Logam kalium sangat penting bagi pertumbuhan makhluk hidup terutama tumbuhan.Tumbuhan membutuhkan garam-garam kalium,tidak sebagai ion K+ sendiri tetapi bersama-sama dengan Ca+2 dalam perbandingan tertentu.
Beberapa senyawa kalium yang banyak digunakan baik dibidang industry maumpun kehidupan sehari-hari,dirangkum pada tabel 1.6 berikut ini.
Tabel 1.6 Manfaat Beberapa Senyawa Dari Logam Kalium
| Nama/Rumus Kimia Senyawa | Manfaat/Kegunaannya |
| KO2 | Sebagai bahan cadangan oksigen dalam tabung bawah tanah, kapal selam dan memulihkan seseorangn yang kercaunan gas. Karena KO2 dapat bereaksi dengan H2O menghasilakan gas O2 reaksinya : 4KO2(s) + H2O(l) → 4KOH(aq) + 3O2(g) |
| KOH | Sebagai bahan pengisi pada pembuatan sabun lunak/lembek |
| KCl | Bersama-sama dengan K2SO4 digunakan sebagai bahan untuk pupuk pada tanaman |
| K2SO4 | Bersama-sama dengan KCl digunakan sebagai bahan untuk pupuk pada tanaman |
| KNO3 | Sebagai bahan peledak, petasan dan kembang api |
| KClO3 | Sebagai bahan peledak, pembuatan korek apidan mercon dan sebagai bahan untuk pembuatan gas Cl2 pada saat direaksikan dengan larutan HCl. |
| K2Cr2O7 | Sebagai bahan pengoksidasi |
| KMnO4 | Sebagai bahan pengoksidasi dan zat desinfektan |
1.6.3 Kegunaan logam alkali lainnya
Selain natrium dan kalium,unsur-unsur logam alkali lainnya juga memiliki beberapa manfaatnya,diantaranya:
· Litium digunakan untuk membuat batrai
· Rubidium (Rb) dan Cesium(Cs) digunakan sebagi permukaan peka cahaya dalam sel fotolistrik yang dapat mengubah cahaya menjadi listrik.
· Li2CO3 digunakan untuk pembuatan beberapa jenis peralatan gelas dan keramik.
BAB II
LOGAM ALKALI TANAH (GOLONGAN II A)
2.1 PENDAHULUAN
Logam alkali tanah terdiri dari 6 unsur yang terdapat digolongan II A ,yang terdiri dari : Berilium (Be) ,Magnesium (Mg), Calcium (Ca), Stronsium (Sr), Barium (Ba), Radium (Ra). Unsur-unsur golongan IIA ini disebut logam alkali tanah karena unsur-unsur ini memiliki sifat-sifat seperti logam dan jika bereaksi dengan air menghasilkan senyawa bersifat basah (alkalin). Adapun di temukan istilah tanah muncul karena oksidasinya sukar larut dalam air, dan banyak ditemukan dalam bebatuan di kerak bumi (tanah). Oleh karena itu, istilah” alkali tanah “ biasa di gunakan untuk menggambarkan kelompok unsur golongan IIA.
Unsur alkali tanah memeiliki reaktifitas tinggi, sehingga tidak ditemukan dalam bentuk monoatomik. Unsur ini juga mudah bereaksi dengan oksigen, dan logam murni yang ada di udara, membentuk lapisan luar pada oksigen.
2.2 SIFAT FISIKA
Logam golongan IIA merupakan logam lunak bewarna keperakan.
Berilim Kalsium Stronsium Barium Magnesium
Gambar 2.1 Tampilan logam-logam alkali tanah
Logam alkali tanah mempunyai titik leleh, titik didih, dan massa. jenis yang rendah, sama seperti logam alkali. Tetapi pada logam alkali tanah terjadi anomali nilai titik leleh dan titik didih, yaitu titik leleh dan titik didih berilium lebih tinggi daripada titik leleh dan titik magnesium meskipun massa jenis dan massa atom magnesium lebih besar dari berilium. Ini berarti pada titik leleh dan titik didih berilium tidak di pengaruhi oleh massa atom dan berat jenis tetepi sangat di pengaruhi oleh ikatan logam. Jari jari atom berilium lebih kecil dari pada jari jari atom magnesium. Oleh karenah itu Ikatan logam berilium lebih dari pada jari jari atom magnesium daripada ikatan logam magnesium akibatnya titik leleh dan titik didih berilium lebih tinggi dari pada titik leleh dan titik didih magnesium.
Fenomena yang sama terjadi pada titik leleh dan titik didih kalsium dibandingkan dengan stronsium, yakni titik didih kalsium lebih tinggi dari pada titik leleh dan titik didih stronsium. Ini menunjukan titik leleh dan titik didih kalsium sangatdi pengaruhi oleh ikatan logam.
Jika pada berlilium dan kalsium, titik leleh dan titik didih sangat di pngaruhi oleh kekuatan ikatan logam, maka titik leleh dan titik didih magnesium, stronsium dan barium sangat di pengaruhi oleh massa atom dan massa jenis, yaitu semakin besar massa atom, semakin sukar menguap sehingga semakin tinggi titik leleh dan titik didih. Massa atom barium > massa atom stronsium > massa atom magnesium. Oleh karenah itu titik leleh dan titik didih barium > stronsium > magnesium. Titik didih dan titik logam alkali tanah lebih tinggi dari pada suhu ruangan. Oleh karena itu, unsur logam alkali tanah berwujud padat pada suhu ruangan.
Tabel 2.1 Data Sifat Fisik Unsur logam Alkali
| Nama Unsur | Tampilan | Titik Leleh (0C) | Titik Didih (0C) | Kerapatan (g/mL) |
| Berilium | Berilium logam putih abu-abu metallic | 1553 | 3043 | 1.86 |
| Magnesium | Magnesium logam abu-abu berkilau | 923 | 1383 | 1.75 |
| Kalsium | Kalsium logam putih keperakan | 1111 | 1713 | 1.55 |
| Stronsium | Stronsium logam putih metalik | 1041 | 1653 | 2.60 |
| Barium | Barium logam abu-abu perak | 987 | 1913 | 3.6 |
2.3 SIFAT PERIODIK
Seperti hal ya unsur unsur logam alkali, sifat periodik dan sifat kimia, unsur logam alkali, tanah sangat di tentuhkan oleh konfigurasi elektronya yang memiliki 2 elektron pada kulit terluarya. Perbedaan sifat unsur yang satu dengan yang lain menunjukan keteraturan, seperti terlihat pada tabel di bawah ini.
Tabel 2.2 Sifat Periodik unsur-unsur logam alkali tanah
| Unsur | Konfigurasi Elektron | Jari-jari Atom (Å) | Energi Ionisasi (Kj/mol) | Keelektronega tifan | Potensial Reduksi (Volt) |
| 4Be | [He] 2s2 | 1,12 | 900 | 1,57 | -1,85 |
| 12Mg | [Ne] 3s2 | 1,60 | 740 | 1,31 | -2,37 |
| 20Ca | [Ar] 4s2 | 1,97 | 590 | 1,00 | -2,87 |
| 38Sr | [Kr] 5s2 | 2,15 | 550 | 0,95 | -2,87 |
| 56Ba | [Xe] 6s2 | 2,22 | 500 | 0,89 | -2,90 |
Berdasarkan data tabel di atas tampak konfigurasin elektron logam alkali tanah elektron valensinya terletak pada subkulit ns2. Karena pada kulit atau periode yang sama jumlah elektron valensi logam alkali tanah (ns2) lebih banyak dari jumlah elektron valensi logam alakali (ns1) maka jari-jari atom unsur unsur logam alkali tanah lebih kecil dari pada jari jari atom logam alkali.
Tetapi meskipun energi ionisasi logam alkali tanah lebih tinggi, namun karena energi hidrasi dari ion M2+ lebih besar dari pada energi hidrasi ion M+, maka logam alkali tanah tetap mudah melepas kan keduaelektron valensinya, dan lebih stabil sebagai ion M2+ .Jari-jari atom logam alkali tanah yang lebih kecil dan muatan intinya yang lebih besar mengakibatkan logam alkali tanah membentuk kristal dengan susunan yang lebih rapat, sehingga mempunyai sifat yang lebih keras daripada logam alkali dan massa jenisnya lebih tinggi.
Berilium mempunyai energi ionisasi yang sangat tinggi dan keelektronegatifan yang cukup besar, kedua hal ini menyebabkan berilium cenderung membentuk ikatan kovalen daripada membentuk ikatan ion.
Potensial reduksi standar logam alkali tanah memiliki harga negatif. Hal ini menunjukkan bahwa logam alkali tanah sukar melakukan reaksi reduksi karena sifat khas logam adalah melepaskan elektron atau melakukan reaksi oksidasi sehingga menyebabkan zat lain melakukan reaksi reduksi. Oleh karena itu, logam-logam alkali tanah merupakan reduktor yang kuat, bahkan kalsium, stronsium, dan barium merupakan reduktor yang lebih kuat daripada natrium.
Minggu, 01 Maret 2015
 19.48
19.48
 Unknown
Unknown
| Unsur | Li | Na | K | Rb | Cs |
| Warna Nyala Api | Merah | Kuning atau Jingga | Ungu | Biru Kemerahan | Biru |
| Nama/Rumus kimia senyawa | Manfaat/Kegunannya |
| NaCl | · Bahan baku untuk membuat natrium(Na), klorin (Cl2), hidrogen (H2) ,hidrogen klorida (HCl) serta senyawa-senyawa natrium lainnya seperti NaOH dan Na2CO3. · Sebagai pengawet susu,pengawet ikan dan daging. · Di negara yang bermusim dingin digunakan untuk mencairkan salju dijalan raya. · Pengolahan bahan makanan yaitu sebgai bumbu masak atau garam dapur |
| NaOH | · Sebagai bahan pada pembuatan sabun dan deterjen.sabun dibuat dengan mereaksikan lemak atau minyak dengan NaOH. · Sebagai bahan pembuatan pulp dan kertas.bahan dasar pembuatan kertas adalah selulosa (pulp) dengan cara memasak kayu,bamboo dan jerami dengan kaustik soda (NaOH) · Sebagai bahan pada pengolahan aluminium Kaustiksoda digunakan untuk mengolah bauksit menjadi Al2O3 (alumina) murni · NaOH juga digunakan dalam industrikecil, plastic, pemurnian minyak bumi serta pembuatan senyawa natrium lainnya seperti NaClO |
| Na2CO3 (Soda Abu) | · Sebagai bahan untuk membentuk sabun damar yang berfungsi menolak air dan pengikat serat selulosa pada pembuatan kertas. · Sebagai penghilang kesadahan air pada industri kaca dan industri deterjen. |
| NaHCO3 (Soda Kue ) | · Sebagai bahan pengembang pada pembuaatan kue |
| Na2S | · Bersama-sama dengan NaOH digunakan pada prose pengolahan pulp sebagai bahan dasar pembuat kertas. |
| Na2SO4 | · Sebagai bahan yang dapat dipakai untuk menyimpan energi surya sehingga dapat dipakai sebagai penghangat ruangan dan penghangat air |
| NaHSO3 | · Sebagai bahan pada proses pembuatan pulp |
| NaCN | · Sebagai bahan untuk ekstraksi emas dan mengeraskan baja |
| NaNO2 | · Sebagai bahan untuk pengawet |
| Na2SiO3 | · Sebagai bahan perekat atau pengisi dalam industry kertas karton dan sabun |
| Na2S2O3 | · Sebagai bahan pencuci dalam fotografi |
| Na2O2 | · Sebagai bahan pemutih makanan |
| Na3Pb8 | · Sebagai bahan pengisi lampu natrium |
| Na-Benzoat | · Sebagai bahan pengawet makanan dalam kaleng dan obat rematik |
| Na-Sitrat | · Sebagai zat anti pembeku darah |
| Na-Glutamat | · Sebagai bahan penyedap makanan |
| Na-Salsilat | · Sebagai obat penurun panas |
Minggu, 22 Februari 2015
 20.48
20.48
 Unknown
Unknown
1.1.PENDAHULUAN
Logam alkali adalah kelompok unsur kimia pada golongan IA dalam tabel periodik,kecuali hidrogen yang merupakan unsur non logam. Kelompok ini terdiri dari : litium ( Li ), natrium (Na), Kalium (K), Rubidium (Rb), Sesium (Cs), dan Fransium (Fr). Semua unsur pada kelompok ini sangat reaktif sehingga secara alami tak pernah di temukan dalam bentuk tunggal. Untuk menghambat reaktivitas , logam alkali harus di simpan dalam medium minyak.
1.2. SIFAT FISIKA
Semua logam alkali merupakan unsur logam yang lunak (mudah di iris atau di potong dengan pisau). Pada saat logam di bersihkan, terlihat warna logam putih mengkilap (seperti perak).
Gambar 1.1. Warna masing-masing logam Litium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Sesium (Cs), dan Fransium (Fr).
Semua logam alkali memiliki titik leleh dan titik didih di atas suhu ruangan, berwujud padat pada suhu ruangan, kecuali sesium. Jika suhu lingkungan pada saat penggukuran melebihi 28 0C maka unsur sesium ini akan berwujud cair .
Tabel 1.1 Data Sifat Fisika unsur logam alkali
| Nama Unsur | Tampilan | Titik Leleh (0C) | Titik Didih (0C) | Kerapatan (g/mL) |
| Litium | Litium mengapung dalam minyak | 180,54 | 1.347,00 | 0,543 |
| Natrium | Potongan natrium di ruang vakum | 97,81 | 903,80 | 0,971 |
| Kalium | Bola kalium dalam cairan parafin | 63,65 | 774 | 0,862 |
| Rubidium | Rubidium dalam ruang vakum | 38,89 | 688 | 1,532 |
| Sesium | Cesium dalam ruang vakum | 28,40 | 678,4 | 1,878 |
Pada tabel diatas tampak bahwa kerapatan atau massa jenis logam Litium ( 0,543 gr/mL ), Natrium (0,971 gr/mL ) dan kalium (0,862 gr/mL ) lebih kecil dari massa jenis air maupun masa jenis minyak atau paraffin. Oleh karena itu ketiga logam tersebut terapung dalam minyak maupun paraffin. Sedangkan untuk rubidium dan Cesium yang memiliki massa jenis berturut-turut (1,532 gr/mL ) dan (1,878gr/mL) adalah lebih besar dari air maupun minyak maka kedua logam tersebut akan tenggelam dalam minyak maupun air.
Massa atom relatif Litium (6,941 sma) ke natrium (22,9898 sma) kemudian ke Kalium (39,098 sma) dan rubidium (85,469 sma) serta cesium (132,905 sma) semakin besar. Secara fisika seharusnya titik leleh dan titik didih dari litium ke cesium semakin besar. Karena semakin besar massa atom semakin sukar menguap sehingga semakin tinggi titik didihnya.
Tetapi faktanya sebagaimana ditunjukkan pada tabel 1.1 diatas ternyata titik leleh dan titik didih logam alkali dari litium ke cesium semakin kecil.hal ini bertentangan dengan fakta massa atom relatifnya. Ini berarti dalam kasus logam alkali massa atom relatif logam kurang berpengaruh terhadap titik leleh maupun titik didih logam tersebut. Lalu faktor apa yang berpengaruh terhadap titik leleh dan titik didih logam-logam alkali tersebut ?
Ini menunjukkan pengaruh ikatan logam terhadap titik leleh dan titik didih logam alkali. Sesuai dengan jari-jari atom, yakni semakin kecil jari-jari atom maka semakin kuat ikatan logam karena semakin besar gaya tarik menarik elektrostatik. Semakin kuat ikatan logam semakin besar energi yang diperlukan untuk memutuskan ikatan logam tersebut sehingga semakin tinggi titik leleh dan titik didih. Jari-jari atom dari litium ke cesium semakin besar, sehingga ikatan logam semakin lemah karena gaya tarik menarik elektrostatiknya semakin lemah sehingga ikatan logam menjadi lebih mudah diputuskan. Oleh karena itu titik leleh dan titik didihnya menjadi semakin kecil.
1.3 SIFAT PERIODIK
Sifat periodik dan sifat kimia unsur logam alkali terutama di tentukan oleh konfigurasi elektronnya yang memiliki satu elektron pada kulit terluarnya. Perbedaan sifat unsur yang satu dengan yang lain menunjukkan keteraturan , seperti terlihat pada tabel di bawah ini :
| Unsur | Konfigurasi Elektron | Jari-jari Atom (Å) | Energi Ionisasi (Kj/mol) | Keelektronega tifan | Potensial Reduksi (Volt) |
| 3Li | [He] 2s1 | 1,52 | 520.2 | 0,98 | -3,045 |
| 11Na | [Ne] 3s1 | 1,86 | 495,8 | 0,93 | -2,711 |
| 19K | [Ar] 4s1 | 2,27 | 418,8 | 0,82 | -2,924 |
| 37Rb | [Kr] 5s1 | 2,47 | 403 | 0,82 | -2,925 |
| 55Cs | [Xe] 6s1 | 2,65 | 375,7 | 0,79 | -2,923 |
Konfigurasi elektron valensi logam alkali adalah ns1 yang berarti terletak pada golongan IA dalam sistem periodic dan menempati blok s.logam alkali mempunyai satu elektron valensi sehingga untuk mencapai stabil dengan konfigurasi oktet,logam alkali lebih mudah melepaskan 1 elektron dan membentuk ion positif bervalensi satu.
L(s) → L(g)+ + e-
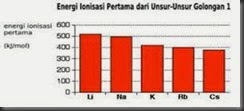
Untuk dapat melepaskan satu elektron valensinya,maka logam alkali membutuhkan energi.energi yang diperlukan oleh atom dalam keadaan gas untuk melepaskan satu elektron valensi,dinamakan: Energi Ionisasi.Besar atau kecilnya harga energi ionisasi suatu atom sangat dipengaruhi oleh jari-jari atom tersebut.Makin besar jari-jari atom suatu atom,makin lemah gaya tarik inti terhadap elektron valensi sehingga makin mudah elektron valensi dilepaskan dan semakin kecil energi ionisasi.Sebagaimana dapat dilihat pada Tabel 1.2,jari-jari atom dari litium ke cesium semakin besar.Oleh karena itu energi ionisasi dari litium ke cesium semakin kecil.
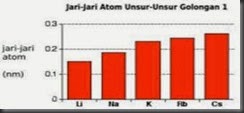
Besar atau kecilnya jari-jari atom sangat ditentukan oleh posisi(nomor kulit) tempat elektron valensi.Semakin besar nomor kulit tempat elektron valensi semakin jauh jaraknya dari inti sehingga semakin besar jari-jari atomnya.Karena yang dimaksud dengan jari-jari atom adalah jarak dari inti atom ke kulit ketempat elektron valensi.Nomor kulit tempat elektron valensi litium,natrium,kalium,rubidium,dan cesium berturut-turut adalah 1,2,3,4 dan 5.Oleh karena itu jari-jari atom cesium (2,65Å) > Rubidium(2,47Å) > Kalium(2,27Å) > Natrium(1,86Å) > Litium(1,52 Å).
(a)
(b)
Gambar 1.2 Grafik perbandingan jari-jari atom (a) dan
energi ionisasi (b) logam alkali
Untuk mencapai stabil dengan konfigurasi oktet,logam alkali lebih mudah melepaskan satu elektron dan membentuk ion positif bervalensi satu,oleh karena itu logam-logam alkali sangat sulit untuk melakukan reaksi reduksi atau reaksi penangkapan elektron,sehingga potensial reduksi semua logam alkali berharga negatif.
Keelektron negatifan adalah kecendrungan suatu atom untuk menarik elektron dalam satu molekul.Karena logam-logam alkali cenderung melepaskan elektron dari pada menarik elektron .Oleh karena itu harga keelektronegatifan logam-logam alkali relatif kecil yakni lebih kecil dari pada satu.Seperti halnya energi ionisasi,maka harga keelektronegatifan logam alkali dipengaruhi oleh jari-jari atomnya.Semakin kecil jari-jari atom semakin dekat jarak dari inti atom keelektron dalam molekul,sehingga makin mudah menarik elektron tersebut dan semakin keelektronegatifannya.